
Mitglied bei
Eine weitere Suchmöglichkeit besteht darin, z.B. bei www.google.de das Suchwort einzugeben und dann nach einem Leerzeichen den Zusatz site:www.cfs-aktuell.de
Sie erhalten dann alle Seiten auf cfs-aktuell.de, auf denen der gesuchte Begriff vorkommt.

Das Chronic Fatigue Syndrom als NO/ONOO-Zyklus-Erkrankung
Von Martin L. Pall, Professor für Biochemie
Übersetzung und online-Veröffentlichung der deutschen Ausgabe mit freundlicher Genehmigung des Autors Martin Pall. Das englische Original finden Sie hier.
|
Übersetzung von Regina Clos |
|
Das Chronic Fatigue Syndrom (CFS) war die erste der Multisystemerkrankungen, von der man annahm, sie sei durch einen Teufelskreis verursacht (1-8), den man jetzt als NO/ONOO-Zyklus bezeichnet (ausgesprochen: no, oh no! (8)), und CFS ist nach wie vor eine Erkrankung, bei der zunehmend überzeugende Argumente für diese Ätiologie geliefert werden können. Bei CFS scheint es die größte Gruppe an auslösenden kurzzeitigen Stressoren zu geben, die in der Literatur über Multisystemerkrankungen beschrieben werden - Stressoren, bei denen von jedem zu erwarten ist, dass er die Stickoxidwerte erhöht. Die meisten dieser Stressoren werden in einem kürzlich erschienen Überblicksartikel beschrieben (9), und diese sowie drei weitere werden in meinem Buch und an anderer Stelle dokumentiert (2,8). Die auslösenden Stressoren, die mit CFS in Zusammenhang gebracht werden, sind: |
.jpg)
Martin Pall, Professor für Biochemie und Grundlagenwissenschaften in der Medizin an der Washington State University |
-
Virale Infektionen
-
Bakterielle Infektionen
-
Durch Einzeller verursachte Infektionen, Toxoplasmose
-
Kohlenmonoxidbelastung
-
Körperliche Traumata
-
Vergiftung durch phosphororganische Verbindungen
-
Schwerer psychologischer Stress
-
Ciguatoxin-Vergiftung
-
Belastung durch ionisierende Strahlen
Während die beiden ersten in dieser Aufzählung am häufigsten als Auslöser von CFS eine Rolle spielen, benötigen wir eine Erklärung für die Beteiligung aller neun Faktoren. Die Tatsache, dass alle neun eine Abfolge von Prozessen in Gang bringen können, die zu einer erhöhten Stickoxid-Synthese führen, muss als frappierende Übereinstimmung betrachtet werden, die uns einen entscheidenden Hinweis auf die Ätiologie des CFS liefert. Tatsächlich bietet die Genforschung ebenfalls eine Unterstützung für die Rolle des Stickoxids bei der Auslösung des CFS: sie belegt, dass das Cortisol-bindende Globulin (10,11) und das Serotonin-Transporter-Gen (12) die Anfälligkeit für CFS bedingen, weil beide dieser Gene die Cortisolfunktion steuern können, und es ist bekannt, dass Cortisol die Induktion der induzierbaren Stickoxidsynthase (iNOS) herabsetzt und damit zum Teil die Stickoxidwerte bedingt (8).
|
Von den neun oben aufgezählten Stressoren wirken die ersten drei hauptsächlich über die Induktion der Stickoxidsynthase (iNOS). Das gilt auch für Stressor 9 (1, 2, 8). Die Mehrzahl der anderen Stressoren wirkt, zumindest teilweise, über die Erhöhung der NMDA-Aktivität [siehe Anm.4, d.Ü.], die wiederum über die beiden anderen Stickoxid-Synthasen wirkt [siehe Anm. 94, d.Ü.], , die nNOS und möglicherweise auch die eNOS (2,8). Folglich ist das gemeinsame Merkmal die Erhöhung der Stickoxidwerte und nicht die spezifische Art oder die Arten der beteiligten Stickoxid-Synthasen. Der Zusammenhang zwischen jedem der ersten sechs Stressoren und dem Stickoxid ist ganz eindeutig. Ich möchte hier die letzten drei besprechen. Nummer 7 in der Liste, schwerer psychologischer Stress, wurde hauptsächlich durch Tiermodelle zur posttraumatischen Belastungsstörungen mit der Stickoxid-Synthese in Verbindung gebracht, in denen gezeigt werden konnte, dass dieser die NMDA-Aktivität und folglich auch die Werte für Stickoxid erhöht. |
Auf der Hauptwebsite von Prof. Martin Pall finden Sie einen ausführlichen, etwa 20-seitigen Artikel, in dem die Hintergründe für diese spezifischen Ausführungen zu CFS dargelegt sind. Dort findet sich auch ein Artikel über Multiple Chemikaliensensibilität. Martin Palls Theorie über die NO/ONOO-Zyklus-Theorie der MCS finden Sie in einer ähnlichen Fassung in deutscher Sprache hier bei PureNature.de. (Original des Artikels hier.) Dort finden Sie auch deutschsprachige Erklärungen zu Begriffen wie Stickoxid, Peroxinitrit, Stickoxid-Synthase, NMDA-Aktivät und weitere Fachbegriffe. Die entsprechende Theorie über Fibromyalgie finden Sie hier. |
Von der Belastung durch Ciguatoxin weiß man, dass dieses Gift das Schließen der Natriumkanäle stark verzögert, und davon weiß man wiederum, dass dies die NMDA-Aktivität ankurbeln kann. Die Rolle des Ciguatoxins bei der Erhöhung der Stickoxid-Werte hat man deshalb abgeleitet aus der bekannten Tatsache, dass die Aktivität der NMDA-Rezeptoren das Stickoxid und sein Oxidationsprodukt, das Peroxinitrit, erhöht.
Ionisierende Strahlen lösen gelegentlich ein CFS-ähnliches Syndrom aus. Radioaktive Bestrahlung ist dafür bekannt, dass sie den Transkriptionsfaktor NF-κB ankurbelt, was wiederum zu erhöhter iNOS-Aktivität und in der Folge zu Stickoxid führt.
Aus dem oben gesagten ergibt sich, dass das Beweismuster, das auf eine erhöhte Aktivität der Stickoxid-Synthese bei der Auslösung von CFS schließen lässt, recht augenfällig ist. Wie aber kann das Stickoxid die Auslösung dieser Krankheiten bewirken? Die Wirkung beruht hauptsächlich auf seinem Oxidationsprodukt, dem Peroxinitrit, wodurch der Mechanismus des NO/ONOO-Zyklusses angestoßen wird, eines Teufelskreises, der für die Chronizität der Erkrankungen verantwortlich ist. Der Mechanismus des NO/ONOO-Zyklusses, den ich bereits auf meiner Website, in meinem Buch (8) und an anderer Stelle (13, 14) veröffentlicht habe, wird unten in Abb. 1 nochmals dargestellt.
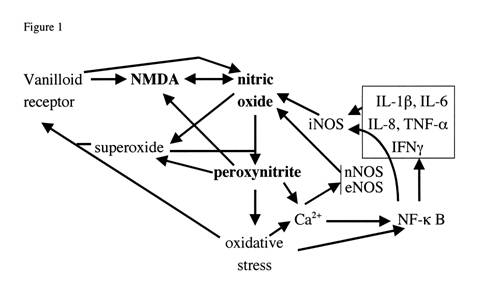
Abbildung 1: Diagramm des NO/ONOO-Zyklusses – eines Circulus Vitiosus. Jeder Pfeil stellt einen oder mehrere Mechanismen dar, durch die die Variable am unteren Ende des Pfeils die Werte für die Variable an der Pfeilspitze ankurbeln kann. Daraus wird deutlich, dass diese Pfeile eine Reihe von Kreisläufen bilden, die sich potentiell ständig weiter in Gang halten und sich gegenseitig ankurbeln. Ein Beispiel wäre das Stickoxid, das das Peroxinitrit erhöht, das wiederum den oxidativen Stress fördert, der das NF-κB ankurbelt, der die Produktion der iNOS erhöht, die wiederum das Stickoxid erhöht. Dieser Kreislauf alleine bildet schon einen potentiellen Teufelskreis, und es gibt eine Reihe anderer Kreisläufe, die in dieser Abbildung dargestellt werden und die alle zusammen einen viel umfangreicheren Teufelskreis bilden können. Wenn man dieser Sichtweise folgt, dann besteht die Herausforderung bei diesen Erkrankungen darin, das gesamte Muster an Erhöhungen herunterzuregulieren, um wieder zu normalen Werten zu gelangen. Sie werden bemerkt haben, dass der Zyklus nicht nur die chemischen Verbindungen Stickoxid, Superoxid und Peroxinitrit umfasst, sondern darüber hinaus noch eine Reihe anderer Komponenten, zu denen der Transkriptionsfaktor NF-κB, oxidativer Stress, fünf inflammatorische Zytokine (im Kasten oben rechts), alle drei Arten der Stickoxid-Synthase (iNOS, nNOS und eNOS) und zwei Rezeptoren gehören, der Vanilloid-Rezeptor und der NMDA-Rezeptor, die auf der neurologischen Ebene eine Rolle spielen.
Sind Komponenten des NO/ONOO-Zyklusses in der chronischen Phase des CFS erhöht?
Die Mechanismen, die im NO/ONOO-Zyklus wirksam sind, werden in vielen meiner Veröffentlichungen sowie umfassend und vollständig in meinem Buch dargestellt (8). Eine sehr wichtige Frage bei der Entscheidung, ob eine spezifische chronische Krankheit/Erkrankung als eine NO/ONOO-Zyklus-Erkrankung in Frage kommt, ist, ob die Komponenten des Zyklusses in der chronischen Phase der Erkrankungen erhöht sind. Die Antwort ist: bei CFS sind sie erhöht, und das gilt auch für andere Multisystemerkrankungen, bei denen man sie untersucht hat, wie MCS (Multiple Chemikaliensensibilität), FM (Fibromyalgie) und PTSD (posttraumatische Belastungsstörung).
Einige der spezifischen Belege bei CFS sind die folgenden (8):
-
Oxidativer Stress wurde in 13 verschiedenen Studien über CFS berichtet, die von sieben unterschiedlichen Forschergruppen in vier Kontinenten veröffentlicht wurden (5, 8). Das Vorliegen eines solchen oxidativen Stresses wird auch unterstützt durch Berichte über Glutathion- und Cystein-Mangel bei CFS (15, 16) und durch Berichte über einen Mangel an essentiellen Fettsäuren bei CFS (17, 18). Oxidativer Stress führt, so nimmt man an, sowohl zu einem Glutathion-/Cystein-Mangel als auch zu einem Mangel an essentiellen Fettsäuren. Diese These habe ich bereits früher aufgestellt (1). Von daher ist oxidativer Stress wahrscheinlich die am besten dokumentierte Veränderung bei CFS. Andererseits ist das keine spezifische Reaktion auf CFS. Viele entzündliche Erkrankungen führen zu einer Erhöhung der Marker für oxidativen Stress, und es kommt noch hinzu, dass viele Fälle von CFS (wahrscheinlich die leichteren Fälle) in die „normale“ Bandbreite für diese Marker fallen. Das gleiche Muster findet man bei vielen anderen Veränderungen, über die bei CFS berichtet wird. Im Durchschnitt sind sie statistisch signifikant verändert, aber in vielen individuellen Fällen von CFS sind sie im Bereich der normalen Werte.
-
Eine Dysfunktion der Mitochondrien bzw. des Energiestoffwechsels ist Teil des NO/ONOO-Zyklus-Mechanismusses, weil das Peroxinitrit eine Reihe von Bestandteilen der Mitochondrien angreift, und Stickoxid und Superoxid hemmen bestimmte Funktionen der Mitochondrien (8). 18 verschiedene Studien liefern Belege für eine Dysfunktion der Mitochondrien und / oder des Energiestoffwechsels bei CFS (ein Überblick findet sich in 1, 8). Diese Studien bieten umfangreiche Belege für die Beteiligung der Biochemie des NO/ONOO-Zyklusses bei CFS. Darunter sind auch Studien, die zeigen, dass Substanzen, von denen man annimmt, dass sie die Mitochondrienfunktion verbessern, wie etwa Carnitin/Acetylcarnitin, Coenzym Q10 und Lipide, die speziell die inneren Membrane der Mitochondrien regenerieren sollen, in der Behandlung des CFS allesamt hilfreich sind. Hier finden sich Belege, dass nicht nur eine Mitochondriendysfunktion vorliegt, sondern dass diese auch zur Pathophysiologie des CFS beiträgt.
-
Zwei Studien berichten über erhöhte Stickoxid-Werte (3, 19). Darüber hinaus berichten drei von fünf Studien über statistisch signifikante Erhöhungen der Neopterin-Werte bei CFS, einem Marker für ein hohes Niveau der iNOS-Induktion. Das lässt darauf schließen, dass die iNOS-Induktion zur Erhöhung der Stickoxide beiträgt (1). Eine Form des Vitamins B12, das Hydroxocobalamin, ein potentes Mittel zum Abfangen des Stickoxids (4), hat in einer placebokontrollierten Studie statistisch signifikante Besserungen bei Patienten mit CFS-ähnlichen Symptomen ergeben (20). Hydroxocobalamin wird seit mehr als 60 Jahren in mindestens 9 Ländern auf drei Kontinenten in der Behandlung CFS-ähnlicher Erkrankungen eingesetzt, meist als intramuskuläre Injektion. Die Patienten berichten über eine rasche Besserung des gesamten Symptomenkomplexes als Reaktion auf die Injektion von Hydroxocobalamin. Das Muster der offenkundigen Wirksamkeit lässt darauf schließen, dass nicht nur das Stickoxid erhöht ist, sondern dass es bei CFS auf zentrale Weise zur Ätiologie beiträgt.
-
Es gibt 10 Studien, die berichten, dass ein oder mehr der inflammatorischen Zytokine, die in der Abbildung im Kasten rechts oben aufgezählt sind, bei CFS erhöht sind (8). Diese Erhöhungen sind relativ mäßig, was darauf schließen lässt, dass sie zwar zur Ätiologie des CFS beitragen, diese aber nicht dominieren.
-
Zwei Mediziner und eine Forschergruppe berichten über klinische Beobachtungen, die eine Erhöhung der NMDA-Aktivität bei CFS belegen, was wiederum die NO/ONOO-Zyklus-Ätiologie bestätigt.
Neben diesen zentralen Überlegungen, die eine NO/ONOO-Zyklus-Ätiologie stützen, gibt es darüber hinaus klinische Beobachtungen aus Therapien, die ebenfalls auf eine Erhöhung der Komponenten des Zyklusses schließen lassen. Einige Ärzte haben beispielsweise in der CFS-Behandlung Substanzen eingesetzt, die bekanntermaßen die NF-κB-Aktivität herabsetzen. Andere haben das Mittel Guaifenisin gegeben, ein Medikament, das die Casaicin-Reaktion vermindert und damit die Funktion des Vanilloid-Rezeptors. Über Thiacetarsamid, einem Mittel, von dem Torello berichtet, es habe in Tiermodellen zum CFS erhebliche Besserungen erbracht, habe ich herausgefunden, dass es sowohl Stickoxid als auch Peroxinitrit abfängt (alle Studien besprochen in 8). Diese Studien lassen zwar vermuten, beweisen jedoch nicht, dass Komponenten des NO/ONOO-Zyklusses heraufreguliert sind und eine Herabregulierung dieser Komponenten eine Besserung mit sich bringen kann und sie deshalb auch zur Ätiologie des CFS beitragen.
Chronic Fatigue Syndrom – Wo sollten wir nach einem spezifischen Biomarker suchen?
Nach dem NO/ONOO-Zyklus-Modell sollte sich die Suche nach spezifischen Biomarkern für spezifische Multisystemerkrankungen auf die Auswirkungen des Zyklusses konzentrieren, die er auf dasjenige Gewebe hat, dessen Dysfunktion am charakteristischsten für eine bestimmte Krankheit ist. Im Falle von MCS, FM und PTSD ist die Frage der Spezifität ganz offensichtlich, weil die charakteristischsten Symptome oder Anzeichen auf der Hand liegen. Bei CFS ist das nicht der Fall. Jedoch haben sich die Überlegungen zum CFS in der letzten Zeit auf das Symptom der Zustandsverschlechterung nach Belastung („post-exertional malaise“) als dem charakteristischsten Symptom konzentriert (21), und meiner Ansicht nach sollten wir uns bei unserer Suche nach einem spezifischen Biomarker genau darauf konzentrieren.
Die Zustandsverschlechterung nach Belastung ist ein Phänomen, bei dem körperliche Belastung bei CFS-Patienten eine Verschlechterung des gesamten Spektrums an Symptomen erzeugt, eine Verschlechterung, die nach dem NO/ONOO-Zyklus-Modell wahrscheinlich die Folge einer Heraufregulierung der Biochemie des NO/ONOO-Zyklusses ist. Die Sichtweise, dass exzessive körperliche Belastung den grundlegenden kausalen Mechanismus bei CFS heraufreguliert, wird schon von den Beobachtungen des ME/CFS-Pioniers Melvin Ramsay untermauert. Ramsay stellte fest, dass CFS-Patienten, die am längsten weiterarbeiteten, bevor sie endgültig nicht mehr konnten, eine wesentlich schlechtere Prognose hatten, als diejenigen, die frühzeitig diagnostiziert worden waren und eine langandauernde Bettruhe einhielten (22).
Wie kann man das Phänomen der Zustandsverschlechterung nach Belastung nutzen, um einen spezifischen Biomarker für CFS zu entwickeln? Als ich diese Frage mit Dr. Paul Cheney besprach und ihm sagte, dass wir unsere Bemühungen zur Entwicklung eines Biomarkers für CFS auf diese Frage konzentrieren sollten, sagte er mir, dass seine CFS-Patienten einen charakteristischen Unterschied zu gesunden Kontrollpersonen aufwiesen: während bei Gesunden die Cortisolwerte nach körperlicher Aktivität anstiegen, sei das bei seinen CFS-Patienten nicht der Fall. Die Vorstellung, dass Veränderungen in der Cortisolreaktivität die Zustandsverschlechterung verursachen könnten, ist äußerst interessant. Von Cortisol und anderen Glucocortidoiden ist bekannt, dass sie die Induktion der induzierbaren Stickoxid-Synthase (iNOS) herabsetzen, und deshalb könnten sie eine beträchtliche Rolle bei der Kontrolle der Stickoxid-Werte spielen. Eine mangelhafte Reaktivität des Cortisols auf körperliche Belastung kann deshalb bei CFS-Patienten nach körperlicher Aktivität – verglichen mit Gesunden – zu erhöhten Stickoxid-Werten führen, die ihrerseits wieder den NO/ONOO-Zyklus heraufregulieren.
Gibt es weitere Belege, die eine spezifische Mangelfunktion der Cortisolregulation bei CFS stützen? Schließlich steuert die HPA-Achse [Hypothalamus-Hypophysen-Nebennieren-Achse] die Cortisolproduktion, und es ist bekannt, dass bei allen diesen Multisystem-Erkrankungen eine Dysfunktion der HPA-Achse vorliegt. Zwei Überblicksartikel lassen darauf schließen, dass die Steuerung der HPA-Achse bei CFS sich von der bei Fibromyalgie unterscheidet (23, 24), und das steht im Einklang mit einer solchen spezifischen Wirksamkeit. Ottenweller et al (25) berichten bei CFS-Patienten über Veränderungen der Cortisolsteuerung als Reaktion auf körperliche Belastung. Seine Ergebnisse sind vergleichbar mit den von Cheney ermittelten Belegen. Dinan und Kollegen (26) berichten, dass die Nebennieren von CFS-Patienten wesentlich kleiner als die gesunder Kontrollpersonen sind, was mit einer Anomalie der Steuerung der HPA-Achse im Einklang steht. Es gibt weitere Studien, die diese Annahme unterstützen (8).
Die Sichtweisen anderer Autoren sind mit denen vergleichbar, die ich hier darlege. Torpy (27) beschrieb CFS-Patienten mit „einer Veränderung der dynamischen Reaktionen des Stress-Systems, insbesondere des Cortisols, auf entsprechende Stimuli.“ Neeck und Crofford (28) berichten „Anomalien zentraler Komponenten der HPA-Achse“ bei CFS.
Was man deshalb vorhersagen kann ist, dass körperliche Belastung, die sich teilweise oder insgesamt durch eine anormale Cortisolsteuerung auswirkt, bei CFS-Patienten eine Heraufregulierung der Biochemie des NO/ONOO-Zyklusses zur Folge hat, einer Reaktion, die man bei gesunden Kontrollpersonen nicht sehen wird. Gibt es für diese These irgendwelche Beweise? Jammes et al (29) berichten bei CFS-Patienten über enorme Anstiege bei Markern für oxidativen Stress nach körperlicher Belastung, während der Anstieg bei gesunden Kontrollpersonen nur geringfügig war. LaManca et al (30) berichteten bei CFS-Patienten über sehr viel stärkerer kognitive Defizite nach körperlicher Betätigung verglichen mit Kontrollpersonen, was übereinstimmt mit der Vorstellung, dass diese kognitiven Defizite durch die Biochemie des NO/ONOO-Zyklusses hervorgerufen werden.
Sogar die bedeutenden Veränderungen der Herzfunktion, die Peckermann et al (31, 32) und Cheney gefunden haben (33 und persönliche Mitteilung), könnten durch herabgesetzte Cortisolwerte verursacht sein, denn Dysfunktionen des Herzens können bei Mensch und Tier durch erniedrigte Cortisolwerte hervorgerufen werden (besprochen in 8, Kap. 5).
Die Vorstellung, das eine Dysfunktion der Cortisolsteuerung als Reaktion auf körperliche Belastung hinter dem Phänomen der Zustandsverschlechterung nach Belastung bei CFS steckt, sollte es ermöglichen, die Steuerung beinahe jeder leicht messbaren Komponente des NO/ONOO-Zyklusses durch körperliche Aktivität zu nutzen, um einen spezifischen Biomarker für CFS zu entwickeln. Zusätzlich kann beinahe jedes leicht messbare Symptom oder Anzeichen des CFS dazu dienen. Ich würde dafür plädieren, die Marker der Stickoxidproduktion vor und nach körperlicher Belastung zu nutzen, aber sicherlich werden andere Forscher zur Messung andere Parameter vorziehen.
CFS und der NO/ONOO-Zyklus
Die zentralen maßgeblichen Belege, die eine NO/ONOO-Zyklus-Ätiologie für CFS stützen, finden sich auf meiner Website und in meinem Buch (8) sowie in obigem Text. Die Belege dafür, dass bei CFS vermutlich ein Stickoxidmechanismus der Krankheitsauslöser ist, sind überzeugend, und sie sind in der Tat noch überzeugender als bei den anderen Multisystemerkrankungen.
Eine Heraufregulierung der Komponenten des NO/ONOO-Zyklusses ist für diejenigen Komponenten belegt, die man gemessen hat, aber etliche wurden bislang nicht direkt untersucht. So gibt es beispielsweise im Unterschied zu FM und MCS keine Belege für eine Erhöhung der Vanilloid-Aktivität bei CFS. Die Peroxinitritwerte wurden bislang nicht untersucht, so dass der einzige einschlägige Beweis dafür aus den Belegen für eine Erhöhung des Stickoxids und für Parameter abgeleitet wird, die das Stickoxid erhöhen (inflammatorische Zytokine und die NMDA-Aktivität), sowie aus Belegen über das Vorliegen von oxidativem Stress. Genauso wurde die Erhöhung der NF-κB-Aktivität nicht direkt untersucht, kann aber sowohl aus den erhöhten Werten für inflammatorische Zytokine als auch für die Stickoxid-Synthase iNOS abgeleitet werden.
Die Bedeutung des NO/ONOO-Zyklus-Modells bei CFS ergibt sich nicht nur aus der großen Vielfalt experimenteller Beobachtungen. Sie sind wichtig, ganz offensichtlich, aber sie sind erst der Anfang dessen, was wir hier brauchen. Wir benötigen hier ein Erklärungsmodell von großer Breite, ein Modell, dass nicht nur eines oder zwei der rätselhaften Merkmale dieser Krankheit erklärt, sondern alle ihrer zentralen Merkmale, sowie die Charakteristika dieser gesamten Gruppe von Multisystemerkrankungen, seien sie ähnlich oder verschieden vom CFS. Es ist das anerkannte Fehlen eines solchen Modells, das immer wieder dazu geführt hat, dass CFS und diese gesamte Gruppe an Erkrankungen als ungeklärt beschrieben wurde. Jetzt können wir argumentieren, dass die gesamte Gruppe an Erkrankungen geklärt ist. Auf meiner Website zähle ich 12 Rätsel über diese Erkrankungsgruppe auf – abgeleitet aus meinem Buch –, die wir nun zum ersten Mal erklären können. Einige dieser Rätsel sind von besonderer Bedeutung für das CFS.
Wir haben die Liste von neun unterschiedlichen kurzfristigen Stressoren, die alle offensichtlich Fälle von CFS auslösen können, Stressoren, die alle eine Abfolge von Prozessen anstoßen können, die zu erhöhten Stickoxid-Werten führen. Wir haben zum ersten Mal eine Erklärung dafür, wie eine Vielfalt an Stressoren zu einer gemeinsamen Reaktion führen kann – der Auslösung von CFS-Fällen.
CFS verläuft chronisch aufgrund der Aktivität des NO/ONOO-Zyklus-Mechanismusses. Wir können erklären, wie die unspezifischen wie auch die spezifischen Symptome und Anzeichen des CFS erzeugt werden. Die spezifischen Symptome wurden hier besprochen, die unspezifischen in meinem Buch (8). Wir können erklären, wieso CFS mit anderen Multisystemerkrankungen und anderen allgemein anerkannten Erkrankungen wie Migräne und Asthma gleichzeitig auftritt. Das ist die Folge davon, dass jeder dieser Krankheiten ähnliche kausale Mechanismen zugrunde liegen.
Wir können die Wirkungsweise bestimmter Substanzen und ganzer Behandlungsprotokolle erklären, die in der Behandlung des CFS erfolgreich zu sein scheinen. Einige habe ich hier besprochen, andere auf meiner Website und in meinem Buch (8). Tatsächlich ist für die vielen Menschen, die unter CFS und verwandten Erkrankungen leiden das Wichtigste daran die vielversprechende Aussicht, dass dieser Mechanismus therapeutische Ansätze verspricht.
Wir können in der Tat die verblüffende quantitative wie qualitative Schwankungsbreite der Symptome und Anzeichen der Erkrankung bei CFS wie auch bei Patienten der gesamten Gruppe der Multisystemerkrankungen erklären.
Es waren die vielen, bislang ungeklärten Merkmale des CFS und anderer Multisystemerkrankungen, die zu dem Argument geführt haben, dass man ein neues Paradigma menschlicher Erkrankungen benötige, um diese zu erklären. Das ist genau das, was wir jetzt haben.
Literatur
1. Pall ML. 2000 Elevated, sustained peroxynitrite levels as the cause of chronic fatigue syndrome. Med Hypoth 54:115-125.
2. Pall ML. 2000 Elevated peroxynitrite as the cause of chronic fatigue syndrome: Other inducers and mechanisms of symptom generation. J Chronic Fatigue Syndr 2000;7(4):45-58.
3. Pall ML. 2002 Levels of nitric oxide synthase product citrulline are elevated in sera of chronic fatigue syndrome patients. J Chronic Fatigue Syndr 10(3/4):37-41.
4. Pall ML. 2001 Cobalamin used in chronic fatigue syndrome therapy is a nitric oxide scavenger. J Chronic Fatigue Syndr 8(2):39-44.
5. Smirnova IV, Pall ML. 2003 Elevated levels of protein carbonyls in sera of chronic fatigue syndrome patients. Mol Cell Biochem 248:93-95.
6. Pall ML. 2005. Nitric oxide and the etiology of chronic fatigue syndrome: Giving credit where credit is due. Med Hypotheses. 2005 Jun 2;
7. Pall ML. 2001 Common etiology of posttraumatic stress disorder, fibromyalgia, chronic fatigue syndrome and multiple chemical sensitivity via elevated nitric oxide/peroxynitrite. Med Hypoth 57:139-145.
8. Pall ML. 2007 Explaining “Unexplained Illnesses”: Disease Paradigm for Chronic Fatigue Syndrome, Multiple Chemical Sensitivity, Fibromyalgia, Post-Traumatic Stress Disorder, Gulf War Syndrome and Others, Haworth Medical Press, in press.
9. De Meirleir K, De Becker P, Nijs J, et al. 2002 CFS etiology, the immune system, and infection. In Chronic Fatigue Syndrome, A Biological Approach, P. Englebienne and K De Meirleir, eds, CRC Press, Boca Raton, pp. 201-228.
10. Torpy DJ, Bachmann AW, Grice JE, et al. 2001 Familial corticosteroid-binding globulin deficiency due to a novel null mutation: association with fatigue and relative hypotension. J Clin Endocrinol Metab 86:3692-3700.
11. Torpy DJ, Bachmann AW, Gartside M, et al. 2004 Association between chronic fatigue syndrome and the corticosteroid-binding globulin geen ALA SER224 polymorphism. Endocrine Res 30:417-429.
12. Narita M, Nishigami N, Narita N, et al. 2003 Association between serotonin transported gene polymorphism and chronic fatigue syndrome. Biochem Biophys Res Commun 311:264-266.
13. Pall ML. 2002 NMDA sensitization and stimulation by peroxynitrite, nitric oxide and organic solvents as the mechanism of chemical sensitivity in multiple chemical sensitivity. FASEB J 16:1407-1417.
14. Pall ML. 2005 Multiple chemical sensitivity: towards the end of controversy. Townsend Lett Doctors Patients Aug/Sept 2005:52-56.
15. Bounos G, Molson J. 1999 Competition for glutathione precursors between the immune system and the skeletal muscle: pathogenesis of chronic fatigue syndrome. Med Hypoth 53:347-349.
16. Droge W, Holm E. 1997 Role of cysteine and glutathione in HIV infection and other diseases associated with muscle wasting and immunological dysfunction. FASEB J 11:1077-1089.
17. Horrobin DF. 1990 Post-viral fatigue syndrome, viral infections in atopic eczema, and essential fatty acids. Med Hypoth 32:211-217.
18. Liu Z, Wang D, Xue Q, et al. 2004 Determination of fatty acid levels in erythrocyte membranes in patients with chronic fatigue syndrome. Nutr Neurosci 6:389-392.
19. Kurup RK, Kurup PA. 2003 Hypothalamic digoxin, cerebral chemical dominance and myalgic encephalomyelitis. Int J Neurosci 113:445-457.
20. Ellis FR, Nasser S. 1973 A pilot study of vitamin B 12 in the treatment of tiredness. Br J Nutr 30:277-283.
21. Carruthers BM, Jain AK, De Meirleir KL, et al. 2003 Myalgic encephalomyelitis/chronic fatigue sydnrome: clinical working case definition, diagnostic and treatment protocols. J Chronic Fatigue Syndr 11(1):7-115.
22. Ramsay MA. 1988 Myalgic Encephalomyelitis and Postviral Fatigue State: The Saga of Royal Free Disease, 2 nd Ed, Gower, London.
23. Demitrack MA, Crofford LJ. 1998 Evidence for and pathophysiologic implications of the hypothalamic-pituitary-adrenal axis dysregulation in fibromyalgia and chronic fatigue syndrome. Ann N Y Acad Sci 840:684-697.
24. Adler GK, Manfredsdottir VF, Rackow RM. 2002 Hypothalamic-pituitary-adrenal axis function in fibromyalgia and chronic fatigue sydrome. The Endocrinologist 12:513-524.
25. Ottenweller JE, Sisto SA, McCarty RC, Natelson BH. 2001 Hormonal responses to exercise in chronic fatigue syndrome. Neuropsychobiology 43:34-41.
26. Scott LV, The J, Reznek R, Martin A, Sohaib A, Dinan TG. 1999 Small adrenal glands in chronic fatigue syndrome: a preliminary computer tomography study. Endocrinology 24:759-768.
27. Torpy DJ. 2001 Neuroendocrinology, genetics and chronic fatigue syndrome. CFS Res Rev 2(4):1-3.
28. Neeck G, Crofford LJ. 2000 Neuroendocrine perturbations in fibromyalgia and chronic fatigue syndrome. Rheum Dis Clin North Am 26:989-1002.
29. Jammes Y, Steinberg JG, Mambrini O, et al. 2005 Chronic fatigue syndrome: assessment of increased oxidative stress and altered muscle excitability in response to incremental exercise. J Intern Med 257:299-310.
30. LaManca JJ, Sisto SA, DeLuca J, et al. 1998 Influence of exhaustive treadmill exercise on cognitive functioning in chronic fatigue syndrome. Am J Med 105(3A):59S-65S.
31. Peckerman A, LaManca JJ, Dahl KA, et al. 2003 Abnormal impedance cardiography predicts symptom severity in chronic fatigue syndrome. Am J Med 326:55-60.
32. Peckerman A, LaManca JJ, Qureshi B, et al. 2003 Baroreceptive reflex and integrative stress responses in chronic fatigue syndrome. Psychosom Med 65:889-895.
